Il vaccino antinfluenzale
nell’era COVID-19
Francesco Landi
Anno: 2022
Caratteristiche:
Un approfondimento sull’importanza del vaccino antinfluenzale tra la popolazione anziana, in particolare durante il periodo pandemico, le sue possibili relazioni con l’infezione da SARS-CoV-2 e uno sguardo alle strategie messe in atto per migliorarne l’efficacia.
FREE DOWNLOADS
Descrizione
Da marzo 2020 lo stato pandemico generato dalla diffusione del virus SARS-CoV-2 ha determinato l’interruzione di molti servizi sanitari, tra cui quelli delle vaccinazioni di routine: ciò ha rappresentato un segnale di arresto importante per la prevenzione di numerose malattie infettive 1-3.
Come raccomandato dall’OMS, anche in Italia è stata ribadita l’importanza di mantenere i servizi vaccinali, anche in corso di pandemia da COVID-19, poiché le vaccinazioni costituiscono una componente fondamentale dei servizi offerti dal Sistema sanitario nazionale e un’interruzione, seppur per un breve periodo, determinerebbe un maggiore rischio di epidemie da malattie prevenibili, che potrebbe quindi portare a un incremento nel numero di decessi e a un’aumentata richiesta di risorse sanitarie 3.
Prima della pandemia da SARS-CoV-2, l’influenza era la malattia infettiva con il burden più elevato soprattutto nella popolazione anziana, sia in termini di diffusione che di impatto socio-sanitario 4.
La forma più efficace di prevenzione dell’influenza è la vaccinazione, in quanto va a ridurre il rischio individuale e il rischio di ospedalizzazione e decesso.
La vaccinazione riduce inoltre il rischio di trasmissione della malattia influenzale a soggetti ad alto rischio di complicanze o ospedalizzazione, così come i costi sociali connessi con morbosità e mortalità 5.
Nonostante ad oggi gli sforzi siano stati rivolti soprattutto alla gestione dello stato pandemico generato dal virus SARS-CoV-2, rimane ancora importante porre l’attenzione al vaccino antinfluenzale, poiché la co-infezione da virus SARS-CoV-2 e da virus influenzale ha un impatto significativo sulla mortalità e sul ricovero in terapia intensiva (rispettivamente 5 volte e 2 volte superiori rispetto ai soggetti senza co-infezione) 6.
Il bersaglio principale del vaccino antinfluenzale è costituito dall’emoagglutinina dell’envelope virale, che consente il legame del virus al recettore della cellula ospite ed è responsabile della fusione del virione con la membrana cellulare.
L’emoagglutinina è costituita da una subunità 1 (“testa”), che contiene la maggior parte degli epitopi neutralizzanti ed è altamente variabile, e una subunità 2 (“gambo”), che è responsabile della fusione del virus con la cellula ospite ed è relativamente stabile.
Ad oggi sono quattro i virus influenzali prevalenti che circolano nella popolazione mondiale: due sottotipi del tipo A (H1N1pdm09 e H3N2) e due lineages del tipo B (Victoria e Yamagata) 7-9.
Tra questi, è importante ricordare che gli anziani sono maggiormente sensibili all’infezione da variante H3N2, assunzione fondamentale durante il processo di sviluppo dei vaccini per questa categoria di soggetti 10.
Da recenti meta-analisi e da revisioni sistematiche, condotte sull’efficacia dei vaccini antinfluenzali, sono emersi dati che confermano come la risposta degli anziani vaccinati alla variante H3N2 sia relativamente più bassa se paragonata a quella di soggetti più giovani (Fig. 1) 11.

Figura 1. Efficacia della vaccinazione antinfluenzale a seconda dei sottotipi virali e delle fasce di popolazione (da Belongia et al., 2016, mod.) 11.
Questo rende ragione del fatto che nell’anno 2016/2017, in cui vi è stata una prevalenza del sottotipo H3N2, in Italia la mortalità stimata per influenza è arrivata a circa 25.000 persone 12.
Le cause di questa scarsa efficacia negli anziani dei vaccini contro il sottotipo H3N2 sono diverse 13:
• la deriva antigenica (una graduale modifica della sequenza degli aminoacidi che compongono le proteine virali in grado di stimolare una risposta immune) 14;
• l’immunosenescenza 15;
• la egg adaptation (la propagazione dei virus nelle uova di gallina embrionate porta alla selezione di varianti, con sostituzioni di aminoacidi vicine al sito di legame del recettore dell’emoagglutinina) 16,17.
Tra queste, in particolare, l’immunosenescenza che si verifica nei soggetti anziani riveste un ruolo importante, perché il fenomeno riduce la risposta al vaccino antinfluenzale, così come a quello contro il SARS-CoV-2 18-20.
Ma come si manifesta l’immunosenescenza?
L’immunosenescenza colpisce tutte le cellule del sistema immunitario:
• nelle cellule dendritiche causa una ridotta migrazione dalla periferia ai linfonodi, una ridotta presentazione dell’antigene, un’alterata induzione di cellule T helper;
• nelle cellule natural killer determina un’azione citotossica più lenta e una ridotta produzione di molecole segnale;
• nei linfociti T, con un’inversione tra linfociti T naïve e linfociti T memoria per l’esposizione permanente agli antigeni e la diminuzione della produzione di cellule T nel timo;
• nei linfociti B causa un decremento nella diversità e nel tipo di anticorpi che sono in grado di produrre;
• nei macrofagi, la cui attività fagocitaria è ridotta, così come l’efficienza del sistema di segnale, con una concomitante e incrementata produzione di citochine;
• nei monociti, che esprimono una ridotta attività fagocitaria 21,22.
Per cercare quindi di attuare una strategia personalizzata e contestualizzare il vaccino antinfluenzale nell’era COVID-19, sono state avanzate varie ipotesi sulla possibile interferenza tra vaccinazione antinfluenzale e infezione da SARS-CoV-2: alcuni studi suggeriscono un ruolo protettivo della vaccinazione antinfluenzale nei confronti del virus SARS-CoV-2 (ipotesi positive), altri ipotizzano un possibile aumento del rischio di infezione da parte di altri virus respiratori in seguito a vaccinazione antinfluenzale (ipotesi negative) e altre ipotesi sono neutrali 23-29.
Tra gli studi che suggeriscono un ruolo protettivo del vaccino antinfluenzale rispetto all’infezione da COVID-19 vi è uno studio osservazionale condotto in Italia 30, che dimostra come alla maggiore percentuale di vaccinazioni negli ultrasessantacinquenni corrisponda una riduzione della mortalità per COVID-19. Ciò potrebbe esser dovuto a una sorta di trained immunity, cioè un’immunità allenata, in cui il vaccino antinfluenzale determinerebbe un’azione antivirale anche rispetto al virus SARS-CoV-2, assieme a una minore infiammazione sistemica, minori sintomi e maggiore velocità di recupero 31 (Fig. 2).

Figura 2. Concetto di trained immunity (immunità allenata) (da Amato et al., 2020; Netea et al., 2020; Conlon et al., 2021, mod.) 24,31,32.
Uno studio più esteso, sempre condotto in Italia, sembra confermare che la sieroprevalenza, l’ospedalizzazione, i ricoveri in terapia intensiva e le morti attribuibili al virus SARS-CoV-2 siano inversamente correlate al tasso di copertura vaccinale influenzale 24.
Una recente meta-analisi internazionale in dica una riduzione del 14% del rischio di contrarre la malattia da SARS-CoV-2 nei soggetti vaccinati per l’influenza rispetto ai non vaccinati 33 (Fig. 3).

Figura 3. Effetti della vaccinazione antinfluenzale sull’infezione da SARS-CoV-2 (da Wang et al., 2021, mod.) 33.
Inoltre, recentemente è stato dimostrato come la co-infezione da virus influenzale e da virus SARS-CoV-2 possa rappresentare un evento decisamente pericoloso: in uno studio condotto nel Regno Unito, la co-infezione era infatti associata a un rischio di morte 5,92 volte superiore rispetto al rischio dei soggetti non infettati da nessuno dei due virus, e 2,27 volte superiore a quello dei soggetti con sola infezione da SARS-CoV-2 6.
Negli anni le strategie sperimentate per migliorare l’efficienza e l’efficacia dei vaccini antinfluenzali sono state diverse: l’uso degli adiuvanti (ad es. MF59), l’aumento della valenza dei vaccini (da tri- a quadri-valenti), l’aumento della quantità di antigene e l’utilizzo di piattaforme di produzione alternative a quella “classica” su uova (ad es. la coltura cellulare MDCK) 34-37.
In particolare, gli adiuvanti sono molecole o composti che posseggono proprietà immunomodulatorie intrinseche e che, quando somministrati in combinazione con un antigene, potenziano efficacemente le risposte immunitarie antigene-specifiche dell’ospite, rispetto a quelle indotte da un vaccino contenente il solo antigene (Fig. 4).
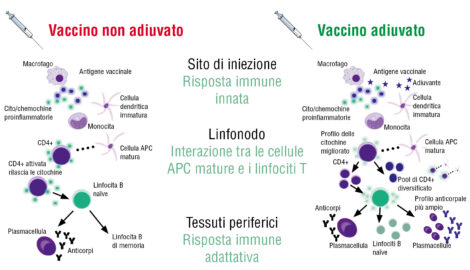
Figura 4. Meccanismo d’azione del vaccino adiuvato rispetto a quello non adiuvato (da Di Pasquale et al., 2015, mod.) 38.
L’uso di adiuvanti nei vaccini risale ai primi anni Trenta, quando fu approvata l’aggiunta degli stessi sali di alluminio per potenziarne l’azione 38.
Il vaccino antinfluenzale adiuvato con MF59 è stato introdotto come vaccino trivalente in Italia nel 1997 38 ed è stato approvato negli USA nel 2015. La forma quadrivalente è stata poi approvata nel 2020 negli USA e in Europa 40,41.
Rispetto al fenomeno dell’immunosenescenza, ossia alla riduzione dell’efficienza di tutte le cellule coinvolte nella risposta immunitaria, il vaccino adiuvato produce negli anziani una risposta immunitaria non solo più ampia e più rapida, ma anche di maggiore qualità 38,42,43.
Il vaccino adiuvato è dunque indicato soprattutto nel paziente anziano, così come nel bambino con un sistema immunitario immaturo, o nei casi di immunosoppressione 38,44.
L’adiuvante MF59 è costituito da un’emulsione oleosa contenente squalene, stabilizzata con tensioattivi non ionici; lo squalene è una normale componente delle membrane cellulari e un prodotto intermedio della biosintesi degli ormoni steroidei, nonché un diretto precursore del colesterolo 34.
Il vaccino adiuvato con MF59 ha numerosi vantaggi rispetto al vaccino non adiuvato, che si esplicano sia a livello del sito di iniezione, sia a livello linfonodale ed ematico: risulta infatti essere più immunogeno, maggiormente cross-reattivo verso i ceppi non inclusi nel vaccino e manifesta una maggiore probabilità di protezione crociata (Tab. I) 34,45-47.
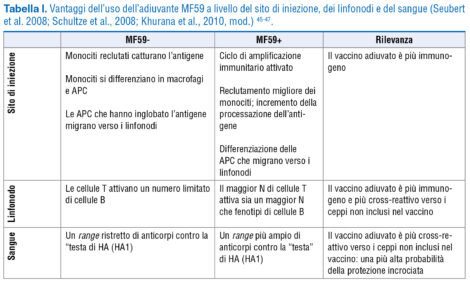
Una recente meta-analisi di 16 trial clinici randomizzati 47 riporta come l’uso di un vaccino antinfluenzale adiuvato con MF59 in soggetti con almeno 65 anni di età determini un migliore tasso di sieroconversione e un maggiore titolo anticorpale rispetto a un vaccino analogo non adiuvato. Il vaccino adiuvato con MF59 risulta più immunogeno verso ceppi antigenicamente dissimili, compreso H3N2 48. In un’altra recentissima revisione sistematica della letteratura e meta-analisi, il vaccino antinfluenzale adiuvato con MF59 in adulti con almeno 65 anni di età ha dimostrato una significativa efficacia vaccinale, maggiore rispetto ai vaccini non adiuvati 49. Inoltre, in un’altra meta-analisi su studi condotti in soggetti di almeno 65 anni di età, il vaccino trivalente adiuvato con MF59 ha dimostrato un’efficacia assoluta sia nell’influenza confermata in laboratorio che nel ridurre l’ospedalizzazione per polmonite e influenza; inoltre, rispetto al vaccino non adiuvato, ha ridotto il ricorso a visite mediche per influenza 49.
Il vaccino adiuvato con MF59 conferisce quindi un vantaggio in termini di persistenza anticorpale, risposta cellulare e immunogenicità crociata 50.
Ad oggi, possiamo dunque dire che il vaccino debba essere cucito sullo specifico paziente e debba considerare i sottotipi virali (i due sottotipi del gruppo A, H1N1 e H3N2, e i due lineages del gruppo B), le tempistiche della vaccinazione, la presenza dell’adiuvante, il numero di dosi e la quantità di antigene contenuta 51.
La più recente raccomandazione del JCVI anglosassone (2021/2022) indica che l’uso del vaccino quadrivalente adiuvato con MF59 è preferibile nei soggetti ultrasessantacinquenni 52.
Le raccomandazioni dell’AIOM per la vaccinazione antinfluenzale in oncologia indicano la “somministrazione del vaccino adiuvato, potenzialmente più immunogenico, soprattutto negli anziani e nei pazienti in corso di immunoterapia” 53.
Anche il Calendario Vaccinale per la Vita, frutto della collaborazione degli esperti delle società scientifiche italiane che si occupano di vaccinazioni e di cure primarie nel bambino e nell’adulto (Società Italiana di Igiene Medicina Preventiva e Sanità Pubblica [SITI], Società Italiana di Pediatria [SIP], Federazione Italiana Medici Pediatri [FIMP] e Federazione Italiana Medici di Medicina Generale [FIMG]) ha proposto di utilizzare nei soggetti di età < 70 anni qualsiasi vaccino quadrivalente non adiuvato disponibile (a seconda dell’indicazione dell’età), mentre per gli anziani di età > 70 anni il vaccino trivalente adiuvato con MF59 54.
Nell’aggiornamento di quest’anno, il Ministero della Salute ha specificatamente indicato nella popolazione ultrasessantacinquenne l’uso del vaccino quadrivalente adiuvato e del vaccino quadrivalente ad alto dosaggio 55.
Per quanto concerne il tema della co-somministrazione del vaccino anti-COVID-19 con il vaccino antinfluenzale, il Ministero della Salute ha disposto, mediante la Circolare del 2 ottobre 2021, che “tenuto conto delle attuali indicazioni espresse dalle principali autorità di Sanità Pubblica internazionali e relativi Comitati consultivi e dei dati preliminari relativi alla co-somministrazione di vaccini anti-SARS-Co-V-2/COVID-19 con vaccini antinfluenzali, sarà possibile programmare la somministrazione dei due vaccini, nel rispetto delle norme di buona pratica vaccinale, nella medesima seduta vaccinale” 56.
Il contenuto della circolare ministeriale si basa sui risultati di recenti studi, in particolare lo studio COMFLUCOV pubblicato su The Lancet, che ha dimostrato la sicurezza e l’immunogenicità della co-somministrazione dei due vaccini: i risultati dimostrano difatti che la risposta immunitaria dei soggetti sottoposti a co-somministrazione rimane preservata nei confronti di entrambi i vaccini, mantenendo al contempo un ottimo profilo di sicurezza 57.
Questi risultati suggeriscono inoltre che la vaccinazione concomitante per la protezione contro il COVID-19 e il virus influenzale potrebbe ridurre l’onere di spesa sui servizi sanitari, incentivando una maggiore adesione alla vaccinazione da parte della popolazione eleggibile.
Bibliografia
1 Istituto Superiore di Sanità. La pandemia COVID-19 e la riduzione o sospensione delle attività vaccinali a livello globale (https://www.epicentro.iss.it/vaccini/covid-19-riduzione-attivita-vaccinale).
2 Istituto Superiore di Sanità. Tutto sulla pandemia di SARS-CoV-2 (https://www.epicentro.iss.it/coronavirus/sars-cov-2).
3 Istituto Superiore di Sanità. Vaccinazioni durante la pandemia da COVID-19: la guida dell’OMS Europa (https://www.epicentro.iss.it/coronavirus/sars-cov-2-servizi-vaccinali).
4 Cassini A, Colzani E, Pini A, et al.; On Behalf Of The BCoDE Consortium. Impact of infectious diseases on population health using incidence-based disability-adjusted life years (DALYs): results from the Burden of Communicable Diseases in Europe study, European Union and European Economic Area countries, 2009 to 2013. Euro Surveill 2018;23:17-00454. https://doi.org/10.2807/1560-7917.ES.2018.23.16.17-00454
5 Ministero della Salute. Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2018-2019 (http://www.trovanorme.salute.gov.it/norme/renderNormsanPdf?anno=2018&codLeg=64381&parte=1%20&serie=null).
6 Stowe J, Tessier E, Zhao H, et al. Interactions between SARS-CoV-2 and influenza, and the impact of coinfection on disease severity: a test-negative design. Int J Epidemiol 2021;50:1124-1133. https://doi.org/10.1093/ije/dyab081
7 Kosik I, Yewdell JW. Influenza hemagglutinin and neuraminidase: Yin-Yang proteins coevolving to Thwart immunity. Viruses 2019;11:346. https://doi.org/10.3390/v11040346
8 Kirkpatrick E, Qiu X, Wilson PC, et al. The influenza virus hemagglutinin head evolves faster than the stalk domain. Sci Rep 2018;8:10432. https://doi.org/10.1038/s41598-018-28706-1
9 Panatto D, Signori A, Lai PL, et al. Heterogeneous estimates of influenza virus types A and B in the elderly: results of a meta-regression analysis. Influenza Other Respir Viruses 2018;12:533-543. https://doi.org/10.1111/irv.12550
10 Caini S, Spreeuwenberg P, Kusznierz GF, et al.; Global Influenza B Study group. Distribution of influenza virus types by age using case-based global surveillance data from twenty-nine countries, 1999-2014. BMC Infect Dis 2018;18:269. https://doi.org/10.1186/s12879-018-3181-y
11 Belongia EA, Simpson MD, King JP, et al. Variable influenza vaccine effectiveness by subtype: a systematic review and meta-analysis of test-negative design studies. Lancet Infect Dis 2016;16:942-951. https://doi.org/10.1016/S1473-3099(16)00129-8
12 Rosano A, Bella A, Gesualdo F, et al. Investigating the impact of influenza on excess mortality in all ages in Italy during recent seasons (2013/14-2016/17 seasons). Int J Infect Dis 2019;88:127-134. https://doi.org/10.1016/j.ijid.2019.08.003
13 Joint Committee on Vaccination and Immunisation. Minute of the meeting on 03 October 2018 (https://app.box.com/s/iddfb4ppwkmtjusir2tc/file/349905639306).
14 Center for Disease Control and Prevention. How flu viruses can change: “drift” and “shift” (https://www.cdc.gov/flu/about/viruses/change.htm).
15 Abedin S, Michel JJ, Lemster B, et al. Diversity of NKR expression in aging T cells and in T cells of the aged: the new frontier into the exploration of protective immunity in the elderly. Exp Gerontol 2005;40:537-548. https://doi.org/10.1016/j.exger.2005.04.012
16 Paules CI, Sullivan SG, Subbarao K, et al. Chasing seasonal influenza – the need for a universal influenza vaccine. N Engl J Med 2018;378:7-9. https://doi.org/10.1056/NEJMp1714916
17 Zost SJ, Parkhouse K, Gumina ME, et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. Proc Natl Acad Sci U S A 2017;114:12578-12583. https://doi.org/10.1073/pnas.1712377114
18 Crooke SN, Ovsyannikova IG, Poland GA, et al. Immunosenescence and human vaccine immune responses. Immun Ageing 2019;16:25. https://doi.org/10.1186/s12979-019-0164-9
19 Del Giudice G, Goronzy JJ, Grubeck-Loebenstein B, et al. Fighting against a protean enemy: immunosenescence, vaccines, and healthy aging. NPJ Aging Mech Dis 2017;4:1. https://doi.org/10.1038/s41514-017-0020-0
20 Müller L, Andrée M, Moskorz W, et al. Age-dependent immune response to the Biontech/Pfizer BNT162b2 coronavirus disease 2019 vaccination. Clin Infect Dis 2021;73:2065-2072. https://doi.org/10.1093/cid/ciab381
21 Palacios-Pedrero MÁ, Osterhaus ADME, Becker T, et al. Aging and options to halt declining immunity to virus infections. Front Immunol 2021;12:1-22. https://doi.org/10.3389/fimmu.2021.681449
22 Isidori A, Loscocco F, Ciciarello M, et al. Immunosenescence and immunotherapy in elderly acute myeloid leukemia patients: time for a biology-driven approach. Cancers (Basel) 2018;10:211.
23 Patwardhan A, Ohler A. The flu vaccination may have a protective effect on the course of COVID-19 in the pediatric population: when does severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) meet influenza? Cureus 2021;13:e12533. https://doi.org/10.7759/cureus.12533
24 Amato M, Werba JP, Frigerio B, et al. Relationship between influenza vaccination coverage rate and COVID-19 outbreak: an Italian ecological study. Vaccines (Basel) 2020;8:535. https://doi.org/10.3390/vaccines8030535
25 Yang MJ, Rooks BJ, Le TT, et al. Influenza vaccination and hospitalizations among COVID-19 infected adults. J Am Board Fam Med 2021;34(Suppl):S179-S182. https://doi.org/10.3122/jabfm.2021.S1.200528
26 Cowling BJ, Fang VJ, Nishiura H, et al. Increased risk of noninfluenza respiratory virus infections associated with receipt of inactivated influenza vaccine. Clin Infect Dis 2012;54:1778-1783. https://doi.org/10.1093/cid/cis307
27 Skowronski DM, De Serres G, Crowcroft NS, et al.; Canadian SAVOIR Team. Association between the 2008-09 seasonal influenza vaccine and pandemic H1N1 illness during Spring-Summer 2009: four observational studies from Canada. PLoS Med 2010;7:e1000258. https://doi.org/10.1371/journal.pmed.1000258
28 Ragni P, Marino M, Formisano D, et al. Association between exposure to influenza vaccination and COVID-19 diagnosis and outcomes. Vaccines (Basel) 2020;8:675. https://doi.org/10.3390/vaccines8040675
29 Pedote PD, Termite S, Gigliobianco A, et al. Influenza vaccination and health outcomes in COVID-19 patients: a retrospective cohort study. Vaccines (Basel) 2021;9:358. https://doi.org/10.3390/vaccines9040358
30 Marín-Hernández D, Schwartz RE, Nixon DF. Epidemiological evidence for association between higher influenza vaccine uptake in the elderly and lower COVID-19 deaths in Italy. J Med Virol 2021;93:64-65. https://doi.org/10.1002/jmv.26120
31 Netea MG, Giamarellos-Bourboulis EJ, Domínguez-Andrés J, et al. Trained immunity: a tool for reducing susceptibility to and the severity of SARS-CoV-2 infection. Cell 2020;181:969-977. https://doi.org/10.1016/j.cell.2020.04.042
32 Conlon A, Ashur C, Washer L, et al. Impact of the influenza vaccine on COVID-19 infection rates and severity. Am J Infect Control 2021;49:694-700. https://doi.org/10.1016/j.ajic.2021.02.012
33 Wang R, Liu M, Liu J. The association between influenza vaccination and COVID-19 and its outcomes: a systematic review and meta-analysis of observational studies. Vaccines (Basel) 2021;9:529. https://doi.org/10.3390/vaccines9050529
34 O’Hagan DT, Rappuoli R, De Gregorio E, et al. MF59 adjuvant: the best insurance against influenza strain diversity. Expert Rev Vaccines 2011;10:447-462. https://doi.org/10.1586/erv.11.23
35 Tisa V, Barberis I, Faccio V, et al. Quadrivalent influenza vaccine: a new opportunity to reduce the influenza burden. J Prev Med Hyg 2016;57:E28-E33.
36 Lee WN, Stück D, Konty K, et al. Large-scale influenza vaccination promotion on a mobile app platform: a randomized controlled trial. Vaccine 2020;38:3508-3514. https://doi.org/10.1016/j.vaccine.2019.11.053
37 Lamb YN. Cell-based quadrivalent inactivated influenza virus vaccine (Flucelvax®Tetra/Flucelvax Quadrivalent®): a review in the prevention of influenza. Drugs 2019;79:1337-1348. https://doi.org/10.1007/s40265-019-01176-z
38 Di Pasquale A, Preiss S, Tavares Da Silva F, et al. Vaccine adjuvants: from 1920 to 2015 and beyond. Vaccines (Basel) 2015;3:320-343. https://doi.org/10.3390/vaccines3020320
39 O’Hagan DT, Ott GS, Nest GV, et al. The history of MF59(®) adjuvant: a phoenix that arose from the ashes. Expert Rev Vaccines 2013;12:13-30. https://doi.org/10.1586/erv.12.140
40 Center for Disease Control and Prevention. Adjuvanted flu vaccine (https://www.cdc.gov/flu/prevent/adjuvant.htm).
41 European Medicines Agency. Fluad Tetra. Summary of product characteristics (https://www.ema.europa.eu/en/documents/product-information/fluad-tetra-epar-product-information_en.pdf).
42 Del Giudice G, Rappuoli R, Didierlaurent AM. Correlates of adjuvanticity: a review on adjuvants in licensed vaccines. Semin Immunol 2018;39:14-21. https://doi.org/10.1016/j.smim.2018.05.001
43 Nanishi E, Dowling DJ, Levy O. Toward precision adjuvants: optimizing science and safety. Curr Opin Pediatr 2020;32:125-138. https://doi.org/10.1097/MOP.0000000000000868
44 Soema PC, Kompier R, Amorij JP, et al. Current and next generation influenza vaccines: formulation and production strategies. Eur J Pharm Biopharm 2015;94:251-263. https://doi.org/10.1016/j.ejpb.2015.05.023
45 Seubert A, Monaci E, Pizza M, et al. The adjuvants aluminum hydroxide and MF59 induce monocyte and granulocyte chemoattractants and enhance monocyte differentiation toward dendritic cells. J Immunol 2008;180:5402-5412. https://doi.org/10.4049/jimmunol.180.8.5402
46 Schultze V, D’Agosto V, Wack A, et al. Safety of MF59 adjuvant. Vaccine 2008;26:3209-3222. https://doi.org/10.1016/j.vaccine.2008.03.093
47 Khurana S, Chearwae W, Castellino F, et al. Vaccines with MF59 adjuvant expand the antibody repertoire to target protective sites of pandemic avian H5N1 influenza virus. Sci Transl Med 2010;2:15ra5. https://doi.org/10.1126/scitranslmed.3000624
48 Nicolay U, Heijnen E, Nacci P, et al. Immunogenicity of aIIV3, MF59-adjuvanted seasonal trivalent influenza vaccine, in older adults ≥ 65 years of age: meta-analysis of cumulative clinical experience. Int J Infect Dis 2019;85S:S1-S9. https://doi.org/10.1016/j.ijid.2019.03.026
49 Coleman BL, Sanderson R, Haag MDM, et al. Effectiveness of the MF59-adjuvanted trivalent or quadrivalent seasonal influenza vaccine among adults 65 years of age or older, a systematic review and meta-analysis. Influenza Other Respir Viruses 2021;15:813-823. https://doi.org/10.1111/irv.12871
50 Kavian N, Hachim A, Li AP, et al. Assessment of enhanced influenza vaccination finds that FluAd conveys an advantage in mice and older adults. Clin Transl Immunology 2020;9:e1107. https://doi.org/10.1002/cti2.1107
51 Levy O. Precision vaccines: using adjuvants to bring precision medicine to vaccinology (https://www.hhs.gov/sites/default/files/For%20Posting_Levy_Precision%20Vaccines_Using%20Adjuvants%20to%20Bring%20Precision%20Medicine%20to%20Vaccinology_16x9_Remediated.pdf).
52 Joint Committee on Vaccination and Immunisation. Advice on influenza vaccines for 2021/2022 (https://app.box.com/s/t5ockz9bb6xw6t2mrrzb144njplimfo0/file/737845224649).
53 Associazione Italiana per l’Oncologia Medica. Raccomandazioni per la vaccinazione antinfluenzale e antipneumococcica in oncologia, edizione 2021 (https://www.aiom.it/wp-content/uploads/2021/01/2021_Racc_vacc_antiinfluenzale_AIOM_agg.pdf).
54 Società Italiana di Igiene Medicina Preventiva e Sanità Pubblica (SITI), Società Italiana di Pediatria (SIP), Federazione Italiana Medici Pediatri (FIMP) e Federazione Italiana Medici di Medicina Generale (FIMG). Calendario Vaccinale per la Vita, edizione 2019 (https://www.vaccinarsinveneto.org/assets/uploads/files/250/Calendario_Vaccinale_per_la_Vita_2019.pdf).
55 Ministero della Salute. Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2021-2022 (http://www.quotidianosanita.it/allegati/allegato4210268.pdf).
56 Ministero della Salute. Circolare del 2/10/2021. Intervallo temporale tra la somministrazione dei vaccini anti-SARS-CoV-2/COVID-19 e altri vaccini (https://www.trovanorme.salute.gov.it/norme/renderNormsanPdf?anno=2021&codLeg=83013&parte=1%20&serie=null).
57 Lazarus R, Baos S, Cappel-Porter H, et al.; ComfluCOV Trial Group. Safety and immunogenicity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT162b2) with seasonal influenza vaccines in adults in the UK (ComFluCOV): a multicentre, randomised, controlled, phase 4 trial. Lancet 2021;398:2277-2287. https://doi.org/10.1016/S0140-6736(21)02329-1




























